미국 매사추세츠주 캠브리지의 뉴베일런트(Nuvalent, 나스닥 NUVL)는 ROS1 양성 선택적 억제제 지데삼티닙(zidesamtinib)의 신약승인신청이 미국 식품의약국(FDA)에 접수됐다고 19일(현지시각) 발표했다.
지데삼티닙은 앞서 최소한 한차례 ROS1 티로신 인산화효소 저해제(TKI)를 사용해 치료를 진행한 전력이 있는 성인 국소진행성 또는 전이성 ROS1 양성 비소세포폐암(NSCLC) 환자들을 위한 치료제로 개발이 진행된 ROS1 선택적 저해제 계열이다. ROS1(c-ros oncogene 1)은 세포의 성장과 생존에 관여하는 티로신키나제수용체(receptor tyrosine kinase, RTKs)의 일원으로서 다양한 암세포에서 변이를 일으키면 암을 유발한다. ROS1 유전자변이는 전체 비소세포폐암의 1~2%(최대 2.6%)를 차지한다.
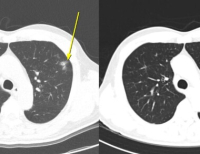
지데삼티닙은 현재 사용 중인 ROS1 저해제들에서 나타나는 제한성 문제를 극복하기 위해 뇌 침투성을 개선했다. 기존 ROS1 저해제들에 내성을 나타내는 종양에서도 활성을 유지할 수 있도록 설계됐다.
처방약생산자수수료법(PDUFA)에 따라 지데삼티닙의 허가 여부는 내년 9월 18일까지 결정될 예정이다. 
뉴베일런트는 1/2상 ‘ARROS-1’ 임상시험 결과를 바탕으로 티로신 인산화효소(키나제_ 저해제를 사용한 적이 있는 진행성 ROS1 양성 비소세포 폐암 환자를 적응증으로 삼아 신약승인신청을 제출했다.
2상 ‘ARROS-1’ 임상시험의 예비자료는 지난 9월 6~9일 스페인 바르셀로나에서 국제 폐암연구협회(IASLC)가 개최한 ‘2025년 폐암 월드 컨퍼런스’에서 발표된 바 있다.
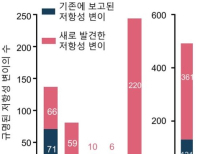
이에 따르면 ROS1 TKI를 포함해 2번 이상 치료받은 적이 있는 환자를 대상으로 객관적반응율(ORR) 44%를 기록했다. 한 가지 ROS1 TKI로 치료받은 환자에 대해서는 51%의 ORR을 보여줬다. TKI로 치료받은 적이 없는(TKI-naive) 환자를 대상으로는 89%의 ORR을 올렸다. 또 암의 뇌전이에 관여하는 G2032R 저항성 돌연변이(resistance mutation)에 대한 활성도를 입증했다.
지데삼티닙은 앞서 2회 이상 ROS1 티로신 인산화효소 저해제를 사용해 치료를 진행한 전력이 있는 ROS1 양성 전이성 비소세포폐암 환자를 치료하는 ‘혁신치료제’로 지정된 바 있다. 아울러 ROS1 양성 비소세포폐암의 치료를 위한 ‘희귀의약품’으로 지정되기도 했다.