비정형 용혈성 요독증후군(非定型溶血性尿毒症候群, atypical hemolytic uremic syndrome, aHUS)은 치명적 희귀 만성 진행성 질환으로 이물질을 파괴하고 제거하는 역할을 담당하는 보체계(補體系, complement system)가 지속적으로 통제 불가능하게 과활성화됨으로써 보체가 적혈구를 공격하고 이로 인해 균열된 적혈구에 노폐물이 축적되고 혈관 안에서 노폐물이 혈전을 형성하고 혈전이 뇌, 심장, 신장, 폐 등 전신에서 문제를 일으키는 가운데 노폐물로 인한 요독증이 신장을 망가뜨리는 증상이 두드러지는 것을 지칭한다.
환자의 40~45%는 18세 이전에 발생한다. 소아 환자는 35~50%가 2세 미만에 이 병에 걸린다. 극희귀질환으로 미국인 100만명 당 한두 명에서 aHUS가 발병한다. aHUS 환자의 급성기 사망률은 5% 미만이다. 30%에 가까운 환자는 만성 콩팥병으로 이행할 수 있다. 수십 년 후에 단백뇨, 고혈압, 신기능의 저하가 나타날 수 있으므로 장기간 추적 관찰해야 한다.
TMA 중 하나인 aHUS의 개념
비정형 용혈성 요독증후군은 넓게 보면 혈전성 미세혈관병증(Thrombotic microangiopathy, TMA)의 한 종류다. 국내에는 약 400명의 환자가 존재하는 것으로 추산된다.
TMA를 세분하면 혈전성 혈소판감소자반증(thrombotic thrombocytopenic purpura, TTP, 일명 Moschowitz Disease), 용혈성 요독증후군(hemolytic-uremic syndrome, HUS), 미세혈관병적 용혈성 빈혈(microangiopathic hemolytic anemia, MAHA) 등이 있다.
혈소판감소자반증은 주로 면역체계에서 ADAMTS13(a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13 : von Willebrand factor-cleaving protease, VWFCP)이라는 효소가 결핍되거나 이에 대한 항체를 생성하는 자가면역질환으로 인해 발생한다. 결핍보다는 자가항체에 의한 경우가 훨씬 많다. ADAMTS13은 혈소판이 과도하게 응집되는 것을 막아주는데, 이 효소가 부족하면 혈소판이 혈관 내에서 과도하게 응고되면서 혈소판 수가 감소하고 혈전이 형성돼 조직과 장기에 손상을 입힐 수 있다.
용혈성 요독증후군은 감염, 유전, 장기이식(면역억제제 투여가 원인), 자가면역질환(전신성 홍반성 루푸스, 항인지질항체증후군 등), 이식 거부반응, 임신, 악성종양, 항암제 투여, 후천성면역결핍증 등에 의해 용혈(적혈구 파괴)과 빈혈, 혈소판감소증 등이 생기는 질환이다.
이 중 대표적인 게 ‘햄버거병’이다. 미국 어린이들이 대장균(O-157:H7)에 오염된 덜 익은 패티가 든 햄버거를 먹은 후 집단으로 이 병에 걸려서 유명해졌다. 대표적인 감염성 용혈성 요독증후군 질환 중 하나다. 시가 독소(Shigatoxin)를 분비하는 대장균인 O157:H7이나 O145형의 감염, 또는 뉴라민분해효소(neuraminidase)를 분비하는 세균의 감염에 의해 발생한다.
미세혈관병적 용혈성 빈혈은 미세혈관 안에 섬유소가 응고됨으로써 지나가는 적혈구에 물리적인 자극이 가해져서 용혈이 일어나 발생하는 빈혈을 의미한다. 적혈구가 깨지므로 용혈과 빈혈이 잇따라 일어난다.
비정형 용혈성 요독증후군은 용혈성 요독증후군의 일반적으로 알려젼 요인(감염, 자가면역반응 등), 즉 정형적 요인이 아닌, 보체계 이상에 의한 비정형적(비특이적) 요인에 의해 발생하는 요독증후군을 일컫는다. 비정형 용혈성 요독증후군은 전체 용혈성 요독증후군의 약 10%를 차지한다.
aHUS 발병 원인 중 유전적 원인(보체의 변이)은 50~70%를 차지한다. 실제로 환자의 절반가량이 유전성으로 진단된다. 특정 유전자 변이가 확인되면 가족 검사가 필요하다.
보체계의 고장은 보체계 조절기능 결핍(THRB(thrombomodulin), CFH(complement factor H), CFI(Complement factor I), MCP(membrane cofactor protein) 변이) 또는 보체 기능 과활성화(CFB(Complement factor B), C3 변이)에 의해 일어난다. 보체계 이상 상태에서 혈장 단백질은 Factor H, Factor I, C3, Factor B 등이 비정상 수치를 보인다. 또 Factor B에 대한 자가항체가 형성된다. 말초혈액 단핵세포에서 MCP가 발현된다.
혈장에서 검출되는 CFH 유전자변이 중 Y402 CFH, H402 CFH 변이는 aHUS와 강력하게 연관돼 있다. CFH 유전자의 변이는 보체계를 교란시켜(보체계 조절기능 결핍으로 인한) 궁극적으로 신장 혈관에서의 과활성화 및 손상을 초래할 수 있다. H402 변이는 aHUS 발병의 흔한 위험 요인이며, Y402 변이에 비해 보체계를 조절하는 능력이 더 저하된 것으로 나타났다.
aHUS의 진단
우선 대장균 독소에 의한 용혈성 빈혈인지 가려내기 위해 대변을 이용한 세균검사를 실시한다. 대장균 독소에 의한 것이며 정형 용혈요독증후군으로 가려낼 수 있다.
다음으로 ADAMTS13 효소(단백)의 활동성 감소가 있는지 파악한다. 유전자검사로 ADAMTS13의 결핍이나 변이가 있다면 혈전성 혈소판감소자반증으로 감별할 수 있다. 아울러 혈전 생성 능력이 어느 정도인지 응고검사를 해서 근거를 보충한다.
발병 연령이 낮고, 재발 성향을 보이거나 가족력 등이 있어 유전성이 의심되는 경우에는 유전자검사를 통해 확인할 수 있다.
aHUS는 보체계 조절과 관련된 유전자 변이에 의해 일어난다고 보는 반면, TTP는 ADAMTS13의 변이에 의해 발병한다고 구분한다.
TTP는 혈소판 감소, 미세혈관병적 용혈성 빈혈, 신경학적 이상 등 3대 증상이 대표적이다. 반면 aHUS는 신기능 저하, 용혈성 빈혈, 혈소판 감소 등 3대 증상이 동시에 나타나야 확진할 수 있다. 두 질환의 감별에는 아직도 이론(異論)의 여지가 있다.
보체계의 보체경로
보체는 면역세포와 식세포의 기능을 보완하는 단백질을 지칭한다. 보체는 병원체나 면역복합체를 녹여 없애고(용균, lysis), 항원에 옵소닌이 결합해 식세포의 포식작용을 강화시키는 역할(옵소닌화, opsonization)을 한다. 이 과정에서 불가피하게 염증이 유발된다.
보체계는 혈장 단백질(약 20종), 세포막 수용체를 포함해 약 50가지의 단백질과 단백질 절편으로 구성돼 있다. 이들 보체는 혈청의 글로불린 분획의 약 10%를 차지한다.
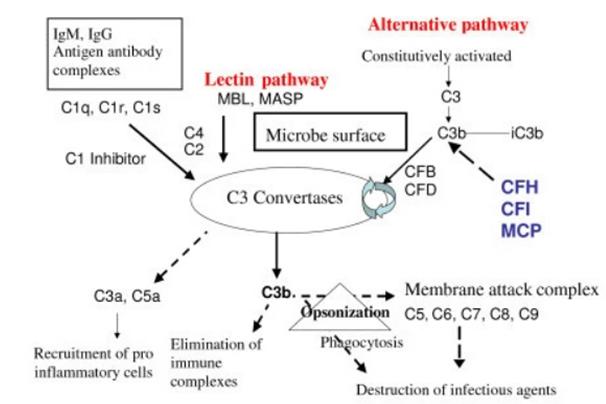 보체계 경로(출처 위키피디아)
보체계 경로(출처 위키피디아)
보체는 항원-항체(IgG) 결합 상태에 추가로 결합한다. C1, C2, C3, C4, C5 … C9로 이어지는 보체 캐스케이드(complement cascade)를 통해 보체반응이 증폭 또는 위축된다. 이 중 중요한 표적이 C3, C5다.
과활성화된 보체가 미세혈관을 공격해 혈전이 생겨 혈류가 막히고 혈류 차단으로 산소 영양분을 공급받지 못한 기관들이 손상된다. 신장은 특히 TMA에 의해 손상될 가능성이 높다.
보체는 세균이나 독소를 공격할 준비가 돼 있다. 그러나 과도한 공격을 막는 온·오프 스위치가 정상적으로 작용하지 않아 ‘온’ 상태가 지속되면, 즉 보체조절 단백질의 결핍 또는 변이가 일어나거나, 자가항체에 의해 보체가 만성적으로 과활성화되면 혈전이 계속 생성돼 aHUS가 나타날 수 있다.
보체계를 활성화시키는 생화학적 경로에는 고전적 경로, 대체 경로, 렉틴 경로 등 3가지 경로가 있다. 대체 경로는 최종 경로 활성화의 중심적인 역할을 하므로 질병에 대한 치료 노력은 대체 경로를 억제하는 데 중점을 두고 있다.
aHUS의 증상
용혈성 빈혈을 기반으로 피로, 권태감 등을 비롯한 다양한 증상이 전신적으로 나타난다. 중추신경계에서는 기억저하, 정신착란, 집중력 저하, 말 어눌함, 두통, 어지럼증 등이 나타난다.
눈에서는 시야 혼탁이 일어난다. 순환기에서는 가슴통증, 호흡곤란이 나타날 수 있다. 호흡기에서는 숨가쁨, 기침, 숨 쉴 때 이상한 소리가 나타난다. 소화기에서는 메스꺼움, 구토, 설사, 복통, 황달 증상을 보인다. 다만 심한 복통과 출혈성 설사는 흔히 발생하지 않는다.
신장 문제로는 소변으로 배출돼야 할 노폐물이 혈액에 축적되는 요독증을 비롯해 고혈압, 부종, 핍뇨, 옆구리통증이 일어난다. 요독증이 생기면 부종이 진행되고, 소변량이 감소한다. 요독 증상이 급격하게 진행되면 오심, 구토가 발생하므로 진단의 보조 근거가 된다. 다만 전체 aHUS 환자의 20%미만에서는 요독증 징후가 없으므로 요독증이 없다고 해서 안심해서는 안 된다. 가장 객관적인 지표는 혈액검사상의 신장기능 수치(크레아티닌)다.
임상병리 검사로는 혈소판 감소, 젖산탈수소효소(LDH, 세포손상 표지) 증가, 적혈구 감소, 크레아티닌 수치 증가, 단백뇨 등이 관찰된다.
aHUS 환자에서는 종종 급성 신부전, 고혈압, 심근경색, 뇌졸중, 폐 합병증, 췌장염, 간 괴사, 뇌병증, 발작, 혼수상태 등이 급작스럽게 발생한다.
aHUS는 희귀질환인데다 증상이 다변적이어서 증상만으로 조기에 자각하기 어렵다. 빈혈과 함께 기력부족, 어지럼증, 흉통, 호흡부전 등이 나타날 수 있지만 이것만으로 aHUS를 분별하기 어렵다. 콩팥 기능이 떨어지면서 요독 증상, 소변량 감소, 전신 부종이 동반되는 게 aHUS 증상의 핵심으로, 증상이 나타나면 사구체여과율 등을 체크해 이상이 있으면 정밀진단에 들어갈 필요가 있다. aHUS 환자 약 6명 중 1명꼴로 초기의 급성신부전 증상이 발병하지 않은 상태에서 만성적인 단백뇨 또는 혈뇨를 경험하게 된다.
환자는 만성 혈전 상태 및 염증 상태를 견뎌야 한다. 이를 위한 대증치료에도 불구하고 일생 중 갑작스럽게 혈액응고, 신부전, 합병증, 조기사망 등이 발생할 위험에 처하게 된다.
aHUS에 대한 고식적 치료
혈장교환술이나 혈장주입술. 혈액투석이 고식적치료로 우선 실시된다. 혈장교환술(Plasma exchange, plasmapheresis)은 혈액에서 혈장을 분리하고 여기서 유해한 물질과 혈구를 제거한 다음 알부민이나 생리식염수를 추가해 주입하는 방법이다. 반면 혈장주입술(Plasma infusion)은 혈액형이 맞는 다른 사람의 혈장만을 추출해 주입한다. aHUS에서는 주로 혈장교환술이 시행된다.
혈장교환술은 혈액 내 혈전과 혈액 관련 단백질(보체 조절인자, 보체에 대한 자가항체)을 제거해 신장 기능을 보호하기 위해 시행된다. 환자의 혈장을 제거하고 신선 동결혈장 등으로 대체 수혈한다. 이를 통해 환자의 95% 이상에서 사망률을 감소시킬 수 있다.
그러나 이는 임기응변적 대처이지 한계가 있다. 이탈리아 코호트 연구에서 aHUS 환자의 발증 시 혈장교환술이나 혈장주입술을 시행했을 경우 55~80%에서 임상적관해가 유도됐으나, 3년의 추적 관찰기간 동안 소아의 48%, 성인의 67%에서 사망하거나 말기 신부전으로 진행된 것으로 보고된 바 있다.
혈소판의 수혈은 혈전성 미세혈관병증을 악화시킬 수 있으므로 금기에 해당한다. 하지만 생명을 위협하는 심각한 출혈이 있는 경우 혈장교환술을 시행한 후 최소한의 혈소판 수혈을 시행할 수 있다. 빈혈에 대해서는 적혈구 수혈을 시행하며, 신부전 소견이 있을 경우 투석을 고려해야 한다. 급성기 후 환자의 5%는 투석에 의존해야 한다.
aHUS이면서 말기신부전(ESRD)에 빠진 환자들은 일반적으로 평생 동안 투석을 하게 되는데 5년 생존율은 34~38%다. 이들 중 전체 사망의 14%가 투석 중 감염으로 인해 나타난다. 투석을 해도 신장 기능은 서서히 망가져 결국 이로 인해 사망한다.
보체계 유전변이의 종류에 따라 5년 후 말기신부전(ESRD)에 도달하는 비율과 고식적 치료(혈장교환술 및 투석치료) 후 재발률이 달라진다. 아울러 신장이식을 해도 보체계 이상이 근본적으로 교정되지 않기 때문에 이식 후에도 aHUS 증상이 재발할 수 있다. 따라서 담당 전문의와 상의해 신중하게 신장이식을 고려해야 한다.
예컨대 Factor H 변이에 의해 aHUS가 발병할 확률은 20~25%이며, 5년 내 ESRD에 도달할 비율은 70~80%다. Factor H 변이에 의한 aHUS 환자 중 고식적 치료에도 불구하고 재발할 확률은 30~50%이며, 이들 중 신장이식 후 재발할 확률은 68~90%로 매우 높다.
모든 유형의 aHUS 환자 중 ‘재발 환자’의 약 3분의 2(65%) 정도의 환자들이 혈장교환술이나 혈장주입술을 받더라도 1년 안에 사망하거나, 투석을 받다가 영구적으로 신장이 손상돼 결국 사망하게 된다.

