미국 의회 자문기구인 신흥 바이오기술 국가안보위원회(National Security Commission on Emerging Biotechnology, NSCEB)가 2040년이면 중국 의약품이 미국 식품의약국(FDA) 허가의 35%를 차지할 것이라고 경고했다.
지난 19일(현지시각) NSCEB는 “중국이 바이오제약 가치사슬(밸류 체인)을 장악하고 있다”며 “중국이 미국을 따라잡는 데 3년이라는 기간이 좁혀질 것”이라고 경고하는 내용의 보고서를 발간했다.
보고서에 따르면, 지난 10년간 중국은 임상시험 규정을 전면 개편하여 한때 세계에서 가장 느리던 승인 절차 중 하나였던 것을 가장 빠른 승인 과정 중 하나로 바꾸었다. 가장 중요한 변화 중 하나는 2018년에 도입된 ‘묵시적 승인’(implied approval) 절차다. 규제 당국이 정해진 기간 내에 반대하지 않으면 신약 임상시험이 자동으로 시작될 수 있게 한 것으로, 승인이 명확한 마감일 없이 1년 이상 걸릴 수 있던 기존 시스템을 대체했다.
2022년 중국기업은 최소 5000만달러의 선불 지급을 받은 신약기술이전 계약이 전체의 5%에 불과했지만 2025년 1분기에는 이 수치가 42%로 상승했다. 보고서는 “중국의 전체적인 혁신 추세는 가속화될 것”이라며, “중국 의약품은 2040년까지 미국 식품의약국(FDA) 허가의 35%를 차지할 것”으로 예상했다.
임상시험의 경우도, 2024년 중국은 세계보건기구(WHO) 국제 데이터베이스에 7100건 이상의 임상시험을 등록하여 미국이 기록한 약 6000건을 추월했다. 2025년 상반기만 해도 미국 제약사들은 중국 기반 기업들과 약 183억달러 규모의 라이선스 도입 계약을 체결했다.
보고서는 “미국 정부가 자국 바이오산업을 촉진하는 필요한 정책을 채택하지 않는 한, 중국의 바이오제약 분야에서의 경쟁 우위가 곧 극복할 수 없는 격차로 확장될 수 있다”고 경고했다.
미국은 역사적으로 바이오기술 분야에서 선두를 달려왔지만, 지난 20년 동안 중국은 체계적으로 수직 통합된 바이오기술 생태계를 구축해 이제 미국의 리더십에 도전할 준비가 된 상황이다. 2025년 4월, NSCEB는 냉정한 결론을 도출했다. 미국 정책 입안자들은 바이오기술 분야의 리더십을 유지하거나, 경우에 따라 회복할 수 있는 3년의 기회가 있으며, 그렇지 않을 경우 군사적, 지정학적, 경제적 이점을 중국에 양보할 위험이 있다.
중국의 새로운 경쟁적 태도는 비시장적 관행과 강력한 경제력을 기반으로 한 전략과 정책에 의해 추진되고 있다. 2025년 12월, 이번에 다시 보고서를 낸 위원회는 3년 이라는 기회의 기간이 예상보다 훨씬 빠르게 닫히고 있다며 미국의 정책 대응을 가속화해야 할 긴급성을 강조한다.
지난 5년 동안 바이오제약 경쟁 구도는 극적으로 변화했다. 중국은 더 이상 단순히 뒤따르는 팔로어가 아니다. 주요 분야에서 중국은 미국과 정면으로 경쟁하고 있으며, 일부 경우에는 앞서 나가고 있다. 최근에는 대형 다국적 제약사들이 혁신적인 약물을 찾기 위해 중국에 눈을 돌리고, 지식재산권(IP)과 라이선스를 받기 위해 수백만 달러, 심지어 수십억 달러를 지불하는 추세가 나타나고 있다.
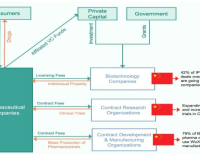
선불 계약금 5000만달러 이상의 IP 라이선스 거래의 급증은 중국 기업들이 글로벌 경쟁력이 있는 국내 바이오제약 혁신을 창출하고 있다는 명확한 증거다. 게다가 이러한 후보물질 중 단 일부만 성공해도, 상당한 미국 자금이 중국 바이오제약 기업으로 유입돼 바이오기술의 다양한 영역에서 복합적인 성장을 촉진하게 돼 중국의 급성장을 부추기는 땔감이 될 수 있다. 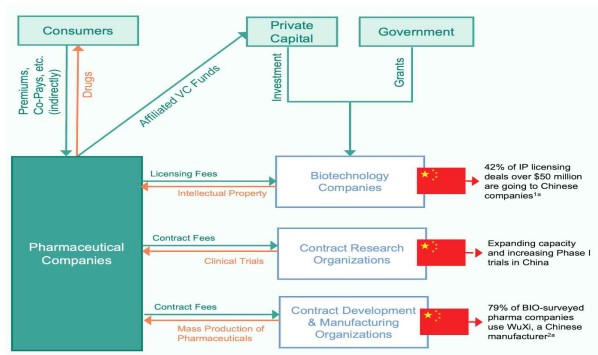 중국의 바이오제약산업 가치사슬 장악 흐름도
중국의 바이오제약산업 가치사슬 장악 흐름도
여기에 그치지 않고 혁신신약 개발로 얻은 수익은 연구 기반 시설을 유지하고, 전 세계 최고의 인재를 유치하며, 농업생명공학, 유전자편집, 바이오제조와 같은 인접 분야에서도 혁신을 일으킬 수 있다. 수준 높은 임상시험 시행이 증가하면서 신약개발 가치사슬의 상부를 지배하는 양상이 나타날 수도 있다. 이는 미국 바이오기술 리더십의 쇠퇴를 가속화하고, 경쟁자인 중국에 비할 데 없는 이점을 제공하는 것이다.
중국은 국제화에 나서 2017년에 인간용 의약품의 기술 요구사항 조화 국제 위원회(ICH)에 가입했다. 덕분에 중국의 의료기관은 다지역 임상시험(MRCT)에 더 초기 단계에서 개입할 수 있게 됐고, 중국 환자들이 실험적 치료에 더 빨리 접근할 수 있게 됐다. 중국이 ICH가 정한 국제 기준을 준수하자 과학적 정당성과 신뢰도가 확보되면 신약 등록에 필요한 임상자료로 중국에서 생산된 것을 수용하기 시작했다.
중국에서 임상시험을 수행하는 비용은 미국보다 훨씬 적고, 1상 임상시험을 시작하는 과정도 훨씬 간단하고 빠르다. 중국의 수많은 연구 기관과 대형 병원이 적극적으로 참여하는 IIT( investigator-initiated trials, 연구자 주도 임상시험)의 확대는 초기 안전성과 유효성 데이터를 제공하면서도, 중국내 산업지원 임상시험(Investigator-Sponsored Trials, IST, 제약사가 비용이나 연구약물을 제공해주는 임상시험)이 가지는 추가적인 규제 제약을 피할 수 있게 하고 있다. 이는 임상연구의 창의성을 높일 수 있다.
중국의 개선된 임상시험 시스템 덕분에 중국 스타트업은 투자 유치와 지적 재산권 라이선스 관심을 끄는데 본질적인 이점을 가지고 있다. 2024년 중국에서 진행된 임상시험의 단 14.3%만이 다국적 기업에 의해 수행되었으며, 대부분의 임상시험은 중국 기업에서 시작되었다. 비록 다국적 기업이 진행하는 임상시험의 비율이 2019년 이후 증가하고 있지만, 중국의 임상시험 개혁은 여전히 주로 중국 기업에 혜택을 주고 있으며, 이들은 초기 단계 시험 결과를 투자자에게 개념 증명(proof-of-concept)으로 사용해 약물을 확장 및 외부 라이선스하는 데 활용하고 있다.
2015년 중국 국무원은 혁신약물의 정의를 개정하고, 혁신 약물의 시장승인 및 심사를 가속화하는 개혁을 도입하여 국내 바이오 제약 혁신을 장려했다. 혁신약물의 정의는 이전에 ‘중국 시장에 출시되지 않은 약물’에서 ‘아직 전 세계 시장에 출시되지 않은 약물’로 수정됐다. 혁신약물의 승인을 신속하게 처리하기 위한 특별심사 제도가 도입됐다. 그 결과 2019년부터 2023년까지 중국 국가약품감독관리국(NMPA)의 승인 혁신 약물 수는 20개에서 66개로 증가했다.
중국의 2019년 의약품관리법은 전국적인 품목허가권(MAH) 제도를 시행하여 마케팅 허가를 공장 소유와 분리했다. MAH 제도를 통해 연구개발(R&D) 중심 기업이 적격 계약 제조 시설에 외주 생산을 맡길 수 있게 되면서 자본 집약도가 낮아졌고, 중국 바이오제약 기업들이 신약후보 발굴, 임상개발, 타사와의 제휴에 전문화를 추구할 수 있게 됐다. 이는 글로벌 경쟁자들과 경쟁하는 데 필수적인 역량이다.
미국 투자은행 회사인 Stifel의 2025년 3월 바이오파마 시장 업데이트 보고서에서 투자자들은 중국의 바이오기술 생태계가 점점 더 혁신적이며, 이용 가능한 파이프라인 규모를 고려할 때 ‘매수자 시장’(Buyer’s Market)이라고 언급했다. 즉 중국에서 저렴하게 구매할 파이프라인이 많아 미국 바이어들의 선택의 폭이 넓다는 것이다. 이런 추세는 향후 10년 내 중국이 신약 발견의 주요 원천이 될 것임을 시사한다.
만약 그렇게 된다면, 전통적으로 주요 제약회사의 파이프라인을 제공해온 미국 스타트업 및 임상 단계 바이오파마 생태계는 중국 기업에 의해 잠식될 것이다. 이러한 광범위한 전임상 및 임상 단계 인프라와 인적 자원을 중국에 넘기게 되면, 미국의 초기 신약개발 역량이 약화되고 중국에 기원(origin)을 둔 혁신신약에 대한 전략적 의존도가 증가하여 미국의 바이오파마 진보가 중국 공산당의 지정학적 목표(일명 中國夢, 一帶一路 등. 다양한 글로벌 분야에서 리더십을 세우는 것)에 더욱 취약하게 될 것이다.
위원회는 또한 임상시험을 중국에서 수행하는 것이 국내 시험 인프라를 약화시킬 뿐만 아니라 미국 기업의 지식재산권 도난, 데이터 유출, 모방 활동에 대한 노출을 증가시킬 수 있다는 우려를 표명한 이해 관계자들의 의견을 소개했다.
한 미국의 이해 관계자는 “모든 혁신적인 미국 바이오 기업마다 비용을 낮추어 그 작업을 복제하려는 ‘그림자’ 중국 기업이 있다”고 언급했다. 위원회 직원들은 이러한 주장을 독립적으로 확인하지는 못했지만, 이는 정부회계국(GAO)이나 FDA 감사관에 의해 추가 연구가 필요하다고 주장했다. 미국 정책 입안자들이 바이오제약 규제에 대한 전략적 개혁을 재검토해야 하고, 미국이 바이오제약 분야에서 글로벌 리더십을 포기한다면 바이오기술 분야 전반의 미국 경쟁력을 뒷받침하는 원동력을 잃게 될 것이라고 지적했다.
중국 베이징 정부는 ‘시장 운영과 정부 지도’를 결합한 새로운 금융 메커니즘을 실험하고 진화시켜왔다. 2002년 이후 중국은 ‘정부지도기금’(Government Guidance Fund, GGF)으로 알려진 민관 합작 벤처캐피털(VC) 펀드를 활용하여 투자 수익률(ROI) 회수까지 시간이 오래 걸릴 수 있는 바이오기술과 같은 신흥 기술의 확장을 위한 ‘인내 자본’(Patient Capital, 단기수익보다는 장기적인 기술혁신과 전략산업 육성을 위해 투자되는 돈)을 제공했다. 지난 10년 동안 이러한 정부지도기금은 전략 기술 산업에 거의 1조달러를 투입했으며, 정부 투자가 민간 VC의 추가 투자를 유치하고 그 영향을 배가시키는 역할을 했다.
2020년까지 중국 관리들은 1500개가 넘는 GGF를 설립했으며, 등록 목표 규모는 1조5500억 달러였다. 일부 GGF는 상하이 생명공학 M&A 펀드와 같이 명시적으로 바이오기술에 투자하는 반면, 다른 펀드들은 국가기술 이전 및 상업화를 위한 펀드와 같이 전략적 신흥산업에 광범위하게 투자했다.
2025년 5월, 중국 3SBio는 단일 약품으로는 역대 최대 규모의 바이오제약 라이선스 계약을 체결했다. 당시 화이자는 중국 3SBio의 PD-1/VEGF 이중 특이성 ‘SSGJ-707’에 대한 중국 외 라이선스 권리를 12억5000만달러 선불 계약금에 사들였다. 마일스톤(40억달러)을 포함한 금액을 합치면 60억5000만달러다.
이는 2024년 중국 아케소(Akeso)가 미국 서밋테라퓨틱스(Summit Therapeutics)에 PD-1 × VEGF 표적 이중특이항체인 이보네시맙(ivonescimab)을 매각하면서 확보한 50억달러를 뛰어 넘었다.
NSCEB는 3SBio의 성공 배경에 있는 혁신 정책을 조사한 결과, 3SBio가 회사의 확장과 성장을 지원하는 공공-민간 자본 유입의 혜택을 받았음을 확인했다. 아울러 이 회사가 랴오닝성 선양(瀋陽)에 위치해 초기 단계 연구를 공급망 입력과 제조와 연계하여 전략적 이점을 누릴 수 있었다고 분석했다.